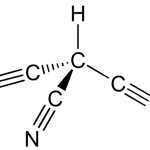
Il aura fallu plus d’un siècle de recherche pour pouvoir mettre en évidence l’existence avérée du cyanoforme, plus communément appelé le tricyanométhane. Pour rappel, il s’agit d’un des acides organiques les plus puissants, soit pKA = -5,1 dans l’eau. Grâce à une équipe de chercheurs de l’Université de Munich, son existence a pu être démontrée et expliquée dans une publication dans la revue scientifique intitulée Angewandte Chemie International Edition. Dans cet article, ils détaillent point par point le cheminement et le détail de leur raisonnement qui a pu les conduire à leur conclusion révolutionnaire dans le monde de la chimie.
1) Le Tricyanométhane : un composé pas tout à fait comme les autres
Depuis plusieurs années, cette molécule est présents dans la plus part des manuels dédiés à la chimie, même s’il n’a jamais pu être synthétisé jusque là, du moins jusqu’à la parution de cet article. Cette recherche aura mis un siècle entier pour pouvoir trouver des réponses : il y a eu de multiples tentatives mais qui n’avaient jamais abouti. Parmi ces recherches, on compte celle de Hermann Schmidtmann en 1896, qui avait utilisé un procédé acido-basique à l’aide de l’acide sulfurique (H2SO4) et du tricyanométhanide de sodium. De nombreux collectifs scientifiques ont succédé aux recherches de Hermann Schmidtmann mais en vain.
3) Des inconvénients notables
Un des inconvénients majeurs de cette découverte est la décomposition à basse température du cyanoforme, ce qui est paradoxal dans le même temps, c’est que sa stabilité devient effective à partir de températures inférieurs à moins 40 degrés celsius.
Pour pouvoir le synthétiser, il faut donc se trouver en milieu anhydre, et implique une réaction acido-basique comprise entre Ca(C(CN)3)2 et le fluorure d’hydrogène (HF), qui correspond à cette équation :
Ca(C(CN)3)2 + 4 HF → 2HC(CN)3 + Ca(HF2)2
Pour que ces recherches soient mises en pratique, il faudra donc pour le moment travailler à température basse et à l’aide du fluorure d’hydrogène, en tant qu’acide et solvant.